伴随着全球新冠肺炎疫情进入第三年,新冠肺炎制造的第一种口服药物似乎即将问世在R&D第一梯队中,君实生物VV116的头对头测试有望很快揭开,公司表示将争取尽快提交境内上市申请,先锋制药表示,普罗库胺的相关工作正在全力推进中第一梯队的三家公司将陆续完成相关临床试验第一批或第一批国产新冠肺炎口服药物会卖给哪家公司,要看临床数据
与此同时,新冠肺炎药品的后来者还在不断增加,加上急诊审评审批政策的加持,临床审批速度大幅提升。
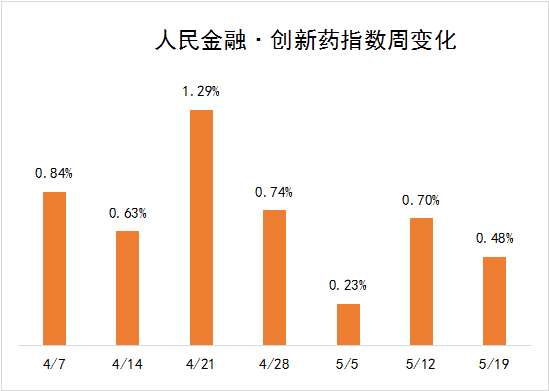
5月13日—5月19日新发布周期内,四环医药,全新生物,众生药业,齐鲁制药6个创新药项目首次获得临床批准,我们将其纳入人民金融创新药指标,同时推进了先正达,智翔医药等创新药物项目的研发进度在这些因素的推动下,人民金融与创新药指数在新发布周期上涨0.48%,最新报2655.99点
日前,《新兴微生物感染》杂志发表了VV116应对奥米克隆感染的临床研究结果这是第一份关于用新冠肺炎生产的小分子药物治疗Omicron感染患者的临床研究结果的同行评审报告
本次试验共纳入136例非重症新冠肺炎住院患者,其中60例在标准治疗基础上接受VV116治疗,76例未接受VV116治疗数据提示,在使用VV116的奥米克隆感染者中,从开始用药到核酸转阴的平均天数为3.52天,在首次核酸检测阳性后5天内使用VV116的患者中,从首次核酸检测到阴性的平均时间为8.56天,短于对照组
据知情人透露,本次研究的对照组可能使用的是帕昔洛韦或中药,比VV116和帕昔洛韦头对头试验开展的更早这种临床试验在一定意义上类似于预实验,为后来的大规模临床试验提供指导事实上,VV116头对头帕昔洛韦的临床试验方案已经在该研究基础上进行了改进,首日剂量从300mg BID扩大到600mg BID
作为新冠肺炎发展最快的口服药物之一,VV116被寄予厚望据介绍,VV116在乌兹别克斯坦的售价为185美元,约合人民币1248元,在中国,VV116的商品名是敏得威目前,VV116头对头临床试验已经完成,机构预计经过28天的临床试验数据,有望在不久的将来揭示盲性
除了君实生物的VV116,real bio的阿夫定和医药行业先锋Procuramide的研发也走在了前面最终,谁能问鼎国内新冠肺炎口腔医学的头把交椅,是目前外界最关心的问题
关于相关进展,5月19日,君实生物在投资者互动平台上表示,公司正在全力加快VV116的研发进度,与药品监管机构保持积极沟通,争取尽快提交在国内的上市申请。
当天,首创药业相关人士告诉我们,目前,我们正在积极推进向中国,美国等国家和地区的国家药监机构申请紧急用药EUA许可相关工作正在全力推进
真人告诉我们不方便透露相关信息事实上,真实生物阿夫定最早完成三期临床试验,有时间优势,但至今没有临床数据公开
由于新冠肺炎三种国产口服药物已经完成或即将完成相关临床试验,能否获批将取决于临床数据,上市越早,市场份额可能越大。
但是,这并不意味着后来者没有机会根据我们的统计,目前第一梯队之外还有10多个新冠肺炎口服药物处于研发阶段,后来者的数量还在不断增加
5月18日晚间,亚圣医药发布公告称,核心品种奥瑞替尼具有治疗新冠肺炎的潜力这意味着国内R&D口腔医药企业在新冠肺炎又增加了一支新军
亚圣药业表示,最新的临床前研究发现,奥瑞替尼可有效抑制新冠肺炎变异株奥米克隆诱导的人外周血单个核细胞细胞因子风暴,提示奥瑞替尼具有治疗新型冠状病毒,尤其是中重度患者的潜力这项研究成果当天发表在欧洲分子生物学组织的顶级期刊《EMBO分子医学》上
据报道,大多数新冠肺炎患者只有轻至中度症状,但仍有15%—20%的患者存在因大量细胞因子产生而导致的过度炎症,即细胞因子风暴,最终导致肺泡损伤和呼吸衰竭因此,寻找能够抑制细胞因子释放的潜在治疗方法对于中重度新冠肺炎患者的治疗非常重要
目前,JAK抑制剂巴里替尼已被FDA正式批准用于新冠肺炎住院患者的治疗,并被纳入世卫组织治疗计划,用于治疗炎症风暴在这项研究中,与泊那替尼和巴里替尼相比,奥瑞替尼对奥米克龙—NTD介导的细胞因子释放表现出更强的抑制作用,有望为中重度新冠肺炎患者提供一种新的治疗选择
新冠肺炎口服药物研发领域的另一个现象是,临床审批速度大幅提高。
比如simcere的SIM0417,今年3月首次获批临床应用,4月初开始临床应用日前,Clinicaltrials.gov显示,simcere开始了SIM0417联合利托那韦治疗轻中度新冠肺炎成年患者的II/III期临床应用几天后,5月16日,simcere再次宣布,SIM0417已获得美国食品药品监督管理局的临床批准,拟用于接触后预防和治疗接触过新冠试验阳性感染的密切接触者这是中国第一个获准进行暴露后预防临床试验的新冠肺炎候选药物
比如众生药业的RAY1216,5月11日公告,接受Ray1216片临床试验申请日前,众生药业宣布RAY1216片获得临床批准从受理到批准临床研究,只需要几天时间,可谓迅速
R&D提速的背后,是相关部门的紧急审批据《光明日报》17日报道,国家美国食品药品监督管理局全力开展疫情期间应急审评审批工作,组织制定了新冠肺炎治疗药物研发3项技术指南,批准了新冠肺炎治疗药物临床试验申请58项,批准清肺排毒颗粒,化湿败毒颗粒,宣肺败毒颗粒注册上市
日前,科技部发布了《新型冠状病毒药物R&D应急项目2022年度申报指南》的通知通知,项目重点研究小分子药物和大分子药物研发的应急需求,具有成熟的临床前有效性和安全性研究基础,产业化转化成功率高,能够快速进入或推进临床研究根据新冠肺炎疫情防控的特殊要求,科技部将择优支持
但伴随着上海疫情的稳定,临床试验使用的患者数量会逐渐减少,给后期的临床试验带来时间和挑战,可能还是要出国进行临床试验,这样的话费用会大大增加。
6个创新药物项目首次获得临床批准。
在新的发布周期中,四环药业,全新生物,众生药业,齐鲁制药6个创新药项目首次获得临床批准,我们将其纳入人民金融创新药指数。
其中,瑞奇制药有限公司的QR060127被批准用于成人的慢性疼痛和炎症性疼痛根据消息显示,目前世界上市场上还没有TRPC5拮抗剂目前只有两种TRPC5拮抗剂处于临床研究阶段,进展最快的是金翅雀生物公司研发的GFB—887,处于临床II期TRPC5拮抗剂的临床适应症包括FSGS,抑郁,焦虑等,但尚未发现与疼痛相关的适应症QR060127是国内首个临床申报的TRPC5拮抗剂,在国际上首次申报炎症性疼痛的适应症有望为疼痛相关疾病提供一种新的临床治疗选择
明生物的IO—108注射液于5月13日获得临床试验批准,用于晚期或转移性实体瘤据介绍,IO—108是一种全新的抑制性抗体,针对髓系细胞免疫检查点的白细胞免疫球蛋白样受体B2这是中国第一个获得临床批准的LILRB2抗体,也是益铭生物在全球获得的第四个临床批准目前,IO—108正在美国进行一期临床试验,以包括晚期实体肿瘤患者
另外,此次获得临床批文的QLS31904是齐鲁制药自主研发的靶向DLL3/CD3的双特异性抗体目前国内只有安进的同靶点药物进入临床,全信生物的QX008N注射液是我国临床批准的第三个TSLP单克隆抗体,四环药业的XZB—0004胶囊是一种高活性,高选择性的AXL靶向抑制剂
临床进展方面,近期,除了SIM0417联合利托那韦在simcere进行轻中度新冠肺炎成人的II/III期临床试验外,智象医药的GR1802也进入了II期临床阶段最近,该公司推出了一项关于GR1802治疗中重度哮喘患者的疗效和安全性的随机,双盲,安慰剂对照和多中心临床试验这些新成分的纳入和R&D的推进是人民金融创新药物指数上升的主要原因



